BIBLIOGRAFIA
(José de San Martín")_(2010)_https://sites.google.com/site/455obtenciondecloro/propiedades-del-cloro-y-metodos-de-obtencion
(carolina sanchez)_(2008)_https://es.scribd.com/user/19007494/Carolina-Sanchez
( Gabriela Mohina y Patricia Moreno)_(Mayo 2011)http://bibliotecadigital.educ.ar/uploads/contents/M-Quimica.pdf
martes, 8 de noviembre de 2016
jueves, 3 de noviembre de 2016
EQUILIBRIO QUÍMICA Y VELOCIDAD DE REACCIÓN
FACTORES QUE AFECTAN EL EQUILIBRIO:
el equilibrio de un sistema se puede desplazar cambiando las
concentraciones; la presión el volumen o la temperatura en efecto la
concentración es un sistema de equilibrio a presión el volumen o la temperatura
constante las concentraciones de reacciones y los productos constantes.
VELOCIDADES DE REACCIONES QUÍMICAS:
una de las características importantes que tiene la velocidad
quimica que es la relación, la cinética química; estática las variaciones es
decir que tan rápido es el reconocimiento se transforma en producto.
FACTORES QUE INFLUYEN LA VELOCIDAD DE REACCIÓN:
la concentracion de reaccionantes la temperatura; catalyzes
y a la naturaleza de los reaccionantes .
¿COMO INFLUYE LA CONCENTRACIÓN DE LA VELOCIDAD DE REACCIÓN?
diferentes reacciones químicas proceden la velocidad de algunas
que parecen rápidas parecen instantes como la neutralización de ácido de
base.
para comprender la influencia sobre la reacción de la velocidad
a partir de la teoría.
¿COMO INFLUYE LA TEMPERATURA SOBRE LA VELOCIDAD DE REACCIÓN?
casi todas las reacciones procede mayor velocidad al aumentar la
velocidad .
acción de los catalizadores en la velocidad de reacción.
muchas reacciones son lentas cuando se mezclan todos los reactivos
porque es posible lograr que se produzca mucho más rapido de la
introducción.
miércoles, 2 de noviembre de 2016
Obtención De Cloruro
Obtención De Cloruro
Elemento químico de peso atómico 35.453. El cloro existe como un gas amarillo-verdoso a temperaturas y presiones ordinarias.
http://quimimanual.blogspot.com.co/2015/04/obtencion-de-cloro.html
Elemento químico de peso atómico 35.453. El cloro existe como un gas amarillo-verdoso a temperaturas y presiones ordinarias.
Propiedades:
El cloro presente en la naturaleza se forma de los isótopos estables de masa 35 y 37. El gas diatómico tiene un peso molecular de 70.906. El cloro es uno de los cuatro elementos químicos estrechamente relacionados que han sido llamados halógenos.
Características del cloro:
Características del cloro:
A continuación puedes ver una tabla donde se muestra las principales características que tiene el cloro.
Cloro
| ||
Símbolo químico
|
Cl
| |
Número atómico
|
17
| |
Grupo
|
17
| |
Periodo
|
3
| |
Aspecto
|
amarillo verdoso
| |
Bloque
|
P
| |
Densidad
|
3.214 kg/m3
| |
Masa atómica
|
35.453 u
| |
Estados de oxidación
|
+-1, +3, +5, +7 (ácido fuerte)
| |
Estado
|
Gaseoso
| |
Punto de fusión
|
171.6 K
| |
Punto de ebullición
|
239.11 K
| |
Propiedades químicas:
Reacciona con el Hidrógeno y los metales:
H2 (g) + CL2 (g) 2 HCL(g)
Esta reacción no se verifica en la oscuridad. Requiere luz difusa. a la luz directa es violenta. Es una reacción fotoquímica.
El hidrógeno arde, previamente encendido, en una atmósfera de cloro con producción de humos blancos de cloruro de hidrógeno.
Reacción del cloro con los no metales:
El cloro, como ya se dijo, se disuelve en agua (3 volumenes de cloro en un litro de agua). En solución se llama agua de cloro. En ella parte del cloro se disuelve dando ácido clorhídrico y ácido hipocloroso.
CL2 (g) + H2O HCL + HCLO
Métodos de obtención:
Métodos de laboratorio: Casi todos los métodos se basan en la oxidación del ácido clorhídrico o de las sales de cloro.
1º Método De Scheele: Oxidación del ácido clorhídrico por la acción de sustancias oxidantes como el MnO2 (dióxido de manganeso).
La reacción es:
4 HCL + MnO2 MnCL2 + 2 H2O + CL2 (g)
Este es un proceso redox.
2º Método De Scheele modificado: en lugar de colocar ácido clorhídrico se usa cloruro de sodio y ácido sulfúrico. De esta manera todo el cloro del cloruro de sodio se libera como cloro:
La reacción es
2 NaCL + MnO2 + 2 H2SO4 Na2SO4 + MnSO4 + 2H2O + Cl2 (g)
3º El empleo de otros oxidantes: si se usa como oxidante el permanganato de potasio la reacción se produce en frío
2 KMnO4 + 16 HCL 2 KCL + 2 MnCL2 + 8 H2O + 5 CL2 (g)
En esta reacción también se produce un proceso de óxido reducción.
Objetivo:
Obtener el gas Cloro mediante reacciones sencillas y básicas para posteriormente proceder a su identificación.
Materiales
|
Reactivos
|
2 placas petri
|
FeSO4
|
1 escobetilla
|
KI
|
Jugo de Uva
| |
Na2SO3
| |
NaClO
| |
H2SO4
| |
BaCl2
| |
KSCN
| |
CuSO4
| |
HNO3
| |
Cu
| |
H2O2
| |
H2O
| |
HCl
| |
NaHSO3
| |
NH2Cl
| |
NaOH
|
Obtencion De Magnesio
Obtención De Magnesio

Como vimos anteriormente, el magnesio es uno de los elementos químicos más abundantes en la naturaleza y se lo encuentra en forma de minerales. El magnesio metálico se obtiene por dos métodos diferentes. Uno de ellos consiste en reducir el mineral en hornos eléctricos con carburo de calcio u otros reductores. En el otro método, el magnesio metálico se obtiene en dos fases: cloruración del mineral (magnesia, dolomía o giobertita) y electrolisis a 700°C del cloruro fundido. El metal se acumula en la superficie del baño y el cloro desprendido se recoge y se aprovecha en la fase de cloruración.
PROPIEDADES
*maleable
*poco dúctil
*se oxida con el contacto al aire húmedo
*resistente a la correcion en atmósferas heladas
APLICACIONES
*se usa como oxidante
*son utilizados en la industria aeronáutica
piezas forjadas

domingo, 23 de octubre de 2016
OBTENCION DE ALCOHOL ETANOL
OBJETIVOS
Obtener alcohol etilico por fermentacion,separarlo y revisar algunas de sus propiedades fisicas y quimicas
Materiales Y Equipos
reactivos
H2SO4 CONC SODIO 1-BUTANOL METANOL
K2CR2O7 ETANOL 2-PROPANOL
MUESTRA
Fermento de Fruta
MATERIALES
*aro de calentamiento *cilindro graduado *pipetas
*Embudo papel filtro *Tubos de ensayo *gradilla
*Balon de destilacion *caja refractaria *mechero
*capsula de porcelana *refrigerante recto *Malla
*Agarraderas con nuez *Soportes Universal *densimetro
PROCEDIMIENTO
*Llenar con Grosella un frasco de vidrio de 1 galon y añadir 1,5 libras de azucar (medidas aproximadas),tapar guardar por un tiempo minimo 2 meses
*filtrar el liquido producido y destilarlo segun la figura hasta obtener 250ml
CONCLUCIONES
Se ha logrado sintetizar los tres tipos de hidrocarburos y lograr demostrar que la mayor energia que tiene el triple y doble enlance de los alquinos y alquenos tienden a romperse y formar otros compuestos reaccionado con otros con mas facilidad de lo que lo hacen los alquinos y reconocer sus diferencias y semejantes con exitos
https://es.scribd.com/doc/80944143/Informe-de-laboratorio-de-quimica-organica-Alcoholes-obtencion-y-propiedades-ESPOL
OBJETIVOS
Obtener alcohol etilico por fermentacion,separarlo y revisar algunas de sus propiedades fisicas y quimicas
Materiales Y Equipos
reactivos
H2SO4 CONC SODIO 1-BUTANOL METANOL
K2CR2O7 ETANOL 2-PROPANOL
MUESTRA
Fermento de Fruta
MATERIALES
*aro de calentamiento *cilindro graduado *pipetas
*Embudo papel filtro *Tubos de ensayo *gradilla
*Balon de destilacion *caja refractaria *mechero
*capsula de porcelana *refrigerante recto *Malla
*Agarraderas con nuez *Soportes Universal *densimetro
PROCEDIMIENTO
*Llenar con Grosella un frasco de vidrio de 1 galon y añadir 1,5 libras de azucar (medidas aproximadas),tapar guardar por un tiempo minimo 2 meses
*filtrar el liquido producido y destilarlo segun la figura hasta obtener 250ml
CONCLUCIONES
Se ha logrado sintetizar los tres tipos de hidrocarburos y lograr demostrar que la mayor energia que tiene el triple y doble enlance de los alquinos y alquenos tienden a romperse y formar otros compuestos reaccionado con otros con mas facilidad de lo que lo hacen los alquinos y reconocer sus diferencias y semejantes con exitos
https://es.scribd.com/doc/80944143/Informe-de-laboratorio-de-quimica-organica-Alcoholes-obtencion-y-propiedades-ESPOL
OBTENCION DE HIDROGENOS
OBTENCION DE HIDROGENOS
Objetivo
Objetivo
Vamos a tratar de observar si tiene lugar una reacción
química cuando mezclamos ácido clorhídrico con diversos metales, como cinc, aluminio y cobre.
Material y productos químicos necesarios
•Cristalizador.
•Gradilla con tubos de ensayo.
•Vaso de precipitados.
•Pipeta y pera de goma para pipetear.
•Matraz erlenmeyer.
•Tubo de seguridad.
•Tapón horadado (dos orificios).
•Tubo de vidrio acodado.
•Ácido clorhídrico, virutas de cinc, aluminio y cobre
PROCEDIMIENTO
Reacción del ácido con los metales
*Toma tres tubos de ensayo y pon en cada uno de
ellos una viruta pequeña de cada metal.
*Llena una pipeta de 20 mL con ácido clorhídrico
(utiliza la pera de goma para pipetear) y vierte en
cada tubo de ensayo 4 ó 5 mL de ácido clorhídrico.
*la experiencia debes realizarla en una campana
de extracción de gases o cerca de la ventana, y
nunca cerca de un mechero encendido. Espera un
par de minutos y observa lo que pasa.
Recogida de un gas en el laboratorio
*De los metales que hayan reaccionado elige uno y
pon unas cuantas virutas en un matraz erlenmeyer.
*Realiza el montaje de la figura: llenas el tubo de
ensayo con agua, lo tapas, lo inviertes sin que cai
ga nada de agua y lo colocas en el cristalizador.
*Es muy importante que el hidrógeno que se va a for
mar dentro del matraz no escape por los agujeros del
tapón horadado. Para evitarlo, pon parafina u otra
sustancia parecida que selle dichas aberturas.
–*Vierte por el tubo de seguridad ácido clorhídrico.
Observarás en el tubo de ensayo la aparición de
unas burbujas. Las primeras en aparecer son del
aire que contenía el matraz erlenmeyer, luego se
rán una mezcla de hidrógeno y aire y, por último,
lunes, 19 de septiembre de 2016
GUANIMIA
ESTRUCTURA QUIMICA

NOMENCLATURA

METODO DE OBTECION
https://www.google.com/search?q=NOMENCLATURA+DE+GUANINA&client=firefox-b&biw=1366&bih=631&noj=1&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjYm4rv7pzPAhWDVyYKHTBjBIAQ_AUICCgB#imgrc=tFKOeu7X1CIB3M%3Ahttp://www.espatentes.com/pdf/2007988_a6.pdf

NOMENCLATURA
METODO DE OBTECION
Se describe un procedimiento para la preparaci
on
de 9 - (2 - hidroxietoximetil) guanina (Acyclo-
vir) mediante tratamiento de cloruro de 2 - ben-
zoiloxietoximetilo y N,2 - acetil guanina y elimi-
naci
on posterior de los grupos acetilo y benzoilo
por hidrazinolisis.https://www.google.com/search?q=NOMENCLATURA+DE+GUANINA&client=firefox-b&biw=1366&bih=631&noj=1&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjYm4rv7pzPAhWDVyYKHTBjBIAQ_AUICCgB#imgrc=tFKOeu7X1CIB3M%3Ahttp://www.espatentes.com/pdf/2007988_a6.pdf
URA
ESTRUTURA QUIMICA
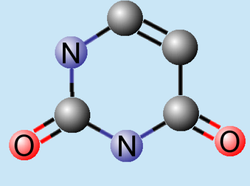
NOMENCLATURA

METODO DE OBTENCION
El uracilo se recicla a si mismo para formar nucleótidos llevando a cabo una serie de reacciones de tipo fosforribosiltransferasa.6 La degradación del uracilo produce substratos, aspartato, dióxido de carbono y amoníaco.6

NOMENCLATURA
METODO DE OBTENCION
El uracilo se recicla a si mismo para formar nucleótidos llevando a cabo una serie de reacciones de tipo fosforribosiltransferasa.6 La degradación del uracilo produce substratos, aspartato, dióxido de carbono y amoníaco.6
Diferencias entre las estructuras de la uridina y la pseudouridina
ACETILENO
ESTRUTURA QUIMICA

NOMENCLATURA

METODO DE OBTENCION
En petroquímica se obtiene el acetileno por quenchinhn (el enfriamiento rápido) de una llama de gas natural o de fracciones volátiles del petróleo con aceites de elevado punto de ebullición. El gas se utiliza directamente en planeta como producto de partida en síntesis alternativa. Un proceso alternativo de síntesis, más apto para el laboratorio, es la reacción de agua con carburo cálcico ; se forma hidróxido de calcio y acetileno, el gas formado en esta reacción a menudo tiene un olor característico a ajo debido a trazas de fosfina que se forman del fosfuro cálcico presente como impureza:
; se forma hidróxido de calcio y acetileno, el gas formado en esta reacción a menudo tiene un olor característico a ajo debido a trazas de fosfina que se forman del fosfuro cálcico presente como impureza:

BIBLIOGRAFIA
https://www.google.com/search?client=firefox-b-ab&biw=1366&bih=631&noj=1&tbm=isch&sa=1&q=acetileno+estru
https://es.wikipedia.org/wiki/Acetileno
https://www.google.com/search?client=firefox-b-ab&biw=1366&bih=631&noj=1&tbm=isch&sa=1&q=acetileno+estructura+QUIMICA&oq=acetileno+estructura+QUIMICA&gs_l=img.3..0i24k1.8525.10425.0.10869.8.2.0.6.6.0.144.285.0j2.2.0....0...1c.1.64.img..0.8.305...0j0i30k1j0i8i30k1.S5vtOxCDYZY#imgrc=YASoDHnCUYrhQM%3A
NOMENCLATURA
METODO DE OBTENCION
En petroquímica se obtiene el acetileno por quenchinhn (el enfriamiento rápido) de una llama de gas natural o de fracciones volátiles del petróleo con aceites de elevado punto de ebullición. El gas se utiliza directamente en planeta como producto de partida en síntesis alternativa. Un proceso alternativo de síntesis, más apto para el laboratorio, es la reacción de agua con carburo cálcico
 ; se forma hidróxido de calcio y acetileno, el gas formado en esta reacción a menudo tiene un olor característico a ajo debido a trazas de fosfina que se forman del fosfuro cálcico presente como impureza:
; se forma hidróxido de calcio y acetileno, el gas formado en esta reacción a menudo tiene un olor característico a ajo debido a trazas de fosfina que se forman del fosfuro cálcico presente como impureza:
BIBLIOGRAFIA
https://www.google.com/search?client=firefox-b-ab&biw=1366&bih=631&noj=1&tbm=isch&sa=1&q=acetileno+estru
https://es.wikipedia.org/wiki/Acetileno
https://www.google.com/search?client=firefox-b-ab&biw=1366&bih=631&noj=1&tbm=isch&sa=1&q=acetileno+estructura+QUIMICA&oq=acetileno+estructura+QUIMICA&gs_l=img.3..0i24k1.8525.10425.0.10869.8.2.0.6.6.0.144.285.0j2.2.0....0...1c.1.64.img..0.8.305...0j0i30k1j0i8i30k1.S5vtOxCDYZY#imgrc=YASoDHnCUYrhQM%3A
lunes, 12 de septiembre de 2016
NOMENCLARURA DE TRIGLICERIDOS
NOMENCLATURA
OBTENCIÓN DE TRIGLICÉRIDOS
Vía exógena
Obtención de triglicéridos a través de la dieta y
absorción de monoacilgliceroles a nivel del intestino.
Vía endógena
Obtención por biosíntesis tanto en el hígado
(síntesis de VLDL) como en el tejido adiposo (síntesis ydegradación).
Triglicéridos
Qué son los triglicéridos?
Los triglicéridos
son el principal tipo de grasa transportado por el organismo. Recibe el nombre
de su estructura química.
Luego de comer, el organismo digiere las grasas de
los alimentos y libera triglicéridos a la sangre. Estos son transportados a
todo el organismo para dar energía o para ser almacenados como grasa.
El hígado también produce triglicéridos
y cambia algunos a colesterol. El hígado puede cambiar cualquier fuente de
exceso de calorías en triglicéridos.
Los niveles de triglicéridos varían con la edad, y
también dependen de qué tan reciente ingirió alimentos antes del examen. La
medición es más precisa si no se ha comido en las 12 horas previas al examen.
El valor normal es de
150 mg/dL.
Para los que sufren problemas
cardiacos los niveles de triglicéridos deben ser inferiores a
los 100 mg./dl.
Si el colesterol tiene un valor normal, un nivel
elevado de triglicéridos no parece ser un factor de riesgo de enfermedad
cardiaca, pero sí puede ser riesgoso al asociarse con
diabetes y
pancreatitis.

martes, 6 de septiembre de 2016
NOMENCLATURA DE AMIDAS
Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida.

Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.

Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso, preceden el nombre de la cadena principal y se nombran como carbamoíl-.......

Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
 http://www.quimicaorganica.org/amidas/250-nomenclatura-de-amidas.html
http://www.quimicaorganica.org/amidas/250-nomenclatura-de-amidas.html
Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso, preceden el nombre de la cadena principal y se nombran como carbamoíl-.......
Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
lunes, 5 de septiembre de 2016
AMIDAS
AMIDA
Una amida es un compuesto orgánico que consiste en una amina unida a un grupo acilo convirtiéndose en una amina ácida (o amida). Por esto su grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).
Formalmente también se pueden considerar derivados del amoníaco, de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente. Concretamente se pueden sintetizar a partir de un ácido carboxílico y una amina.
Suscribirse a:
Comentarios (Atom)








